نشرت مجلة JAMA Oncology (IF 33.012) مؤخرًا نتيجة بحثية مهمة [1] أجراها فريق البروفيسور تساي قوه رينج من مستشفى السرطان بجامعة فودان والبروفيسور وانج جينج من مستشفى رينجي بكلية الطب بجامعة شنغهاي جياو تونغ، بالتعاون مع KUNYUAN BIOLOGY: "الكشف المبكر عن الأمراض الجزيئية المتبقية وتقسيم المخاطر لسرطان القولون والمستقيم من المرحلة الأولى إلى الثالثة عن طريق مثيلة الحمض النووي للورم المتداول وتقسيم المخاطر). "تُعد هذه الدراسة أول دراسة متعددة المراكز في العالم تطبق تقنية مثيلة الحمض النووي متعدد الجينات ctDNA المستندة إلى تفاعل البوليميراز المتسلسل للتنبؤ بتكرار الإصابة بسرطان القولون والمستقيم ومراقبته، مما يوفر مسارًا وحلًا تقنيًا أكثر فعالية من حيث التكلفة مقارنة بطرق تقنية الكشف عن MRD الحالية، والتي من المتوقع أن تحسن بشكل كبير الاستخدام السريري للتنبؤ بتكرار الإصابة بسرطان القولون والمستقيم ومراقبته، وتحسن بشكل كبير من بقاء المريض ونوعية حياته. حظيت الدراسة بتقييم عالٍ من المجلة ومحرريها، وأُدرجت كورقة بحثية توصية رئيسية في هذا العدد، ودُعي البروفيسور خوان رويز-بانوبري من إسبانيا والبروفيسور أجاي جويل من الولايات المتحدة لمراجعتها. كما نُشرت الدراسة على موقع GenomeWeb، وهو موقع إعلامي رائد في مجال الطب الحيوي في الولايات المتحدة.

سرطان القولون والمستقيم (CRC) هو ورم خبيث شائع في الجهاز الهضمي في الصين. تُظهر بيانات الوكالة الدولية لبحوث السرطان (IARC) لعام 2020 أن 555000 حالة جديدة في الصين تمثل حوالي ثلث العالم، مع ارتفاع معدل الإصابة إلى المركز الثاني من بين أنواع السرطان الشائعة في الصين؛ 286000 حالة وفاة تمثل حوالي ثلث العالم، وتحتل المرتبة الخامسة بين أكثر أسباب وفيات السرطان شيوعًا في الصين. السبب الخامس للوفاة في الصين. تجدر الإشارة إلى أنه من بين المرضى الذين تم تشخيصهم، فإن مراحل TNM الأولى والثانية والثالثة والرابعة هي 18.6٪ و 42.5٪ و 30.7٪ و 8.2٪ على التوالي. أكثر من 80٪ من المرضى في المراحل المتوسطة والمتأخرة، و 44٪ منهم لديهم نقائل بعيدة متزامنة أو غير متزامنة إلى الكبد والرئة، مما يؤثر بشكل خطير على فترة البقاء على قيد الحياة، ويعرض صحة سكاننا للخطر ويسبب عبئًا اجتماعيًا واقتصاديًا ثقيلًا. وفقًا لإحصاءات المركز الوطني للسرطان، يتراوح متوسط الزيادة السنوية في تكلفة علاج سرطان القولون والمستقيم في الصين بين 6.9% و9.2%، وقد تصل نفقات الرعاية الصحية الشخصية للمرضى خلال عام واحد من التشخيص إلى 60% من دخل الأسرة. يعاني مرضى السرطان من هذا المرض ويواجهون ضغوطًا اقتصادية كبيرة [2].
يمكن إزالة 90% من أورام سرطان القولون والمستقيم جراحيًا، وكلما كُشف الورم مبكرًا، ارتفع معدل البقاء على قيد الحياة لمدة خمس سنوات بعد الاستئصال الجراحي الجذري، إلا أن معدل الانتكاس الإجمالي بعد الاستئصال الجذري لا يزال حوالي 30%. تبلغ معدلات البقاء على قيد الحياة لمدة خمس سنوات لسرطان القولون والمستقيم لدى السكان الصينيين 90.1% و72.6% و53.8% و10.4% للمراحل الأولى والثانية والثالثة والرابعة على التوالي.
يُعدّ المرض المتبقي الضئيل (MRD) سببًا رئيسيًا لتكرار الورم بعد العلاج الجذري. في السنوات الأخيرة، شهدت تقنية الكشف عن المرض المتبقي الضئيل للأورام الصلبة تطورًا سريعًا، وقد أكدت العديد من الدراسات الرصدية والتدخلية المهمة أن حالة المرض المتبقي الضئيل بعد الجراحة قد تشير إلى خطر تكرار سرطان القولون والمستقيم. يتميز اختبار الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) بأنه غير جراحي، وبسيط، وسريع، مع سهولة الوصول إلى العينات، وتجاوز تباين الأورام.
تنصّ إرشادات اللجنة الوطنية الأمريكية لسرطان القولون والمستقيم (NCCN) وإرشادات اللجنة الصينية لسرطان القولون والمستقيم (CSCO) على أنه لتحديد خطر الانتكاس بعد الجراحة واختيار العلاج الكيميائي المساعد في سرطان القولون، يُمكن لاختبار الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) أن يُوفّر معلومات تشخيصية وتنبؤية تُساعد في اتخاذ قرارات العلاج المساعد لمرضى سرطان القولون في المرحلتين الثانية والثالثة. ومع ذلك، تُركّز معظم الدراسات الحالية على طفرات الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) القائمة على تقنية التسلسل عالي الإنتاجية (NGS)، والتي تتميز بعملية مُعقّدة، ومدة زمنية طويلة، وتكلفتها العالية [3]، مع نقص طفيف في إمكانية التعميم وانخفاض معدل الانتشار بين مرضى السرطان.
في حالة مرضى سرطان القولون والمستقيم في المرحلة الثالثة، تصل تكلفة المراقبة الديناميكية للحمض النووي الريبوزي منقوص الأكسجين (ctDNA) القائمة على تقنية الجيل التالي من الجينوم (NGS) إلى 10,000 دولار أمريكي للزيارة الواحدة، وتتطلب فترة انتظار تصل إلى أسبوعين. مع اختبار الميثلة متعدد الجينات في هذه الدراسة، ColonAiQ®، يمكن للمرضى الحصول على مراقبة ديناميكية للحمض النووي الريبوزي منقوص الأكسجين (ctDNA) بعُشر التكلفة، والحصول على تقرير في غضون يومين فقط.
وفقًا لـ 560.000 حالة جديدة من سرطان القولون والمستقيم في الصين كل عام، فإن المرضى السريريين الذين يعانون بشكل أساسي من سرطان القولون والمستقيم في المرحلة الثانية والثالثة (النسبة حوالي 70٪) لديهم طلب أكثر إلحاحًا على المراقبة الديناميكية، ثم يصل حجم سوق المراقبة الديناميكية MRD لسرطان القولون والمستقيم إلى ملايين الأشخاص كل عام.
يتضح أن نتائج البحث ذات أهمية علمية وعملية بالغة. فقد أكدت دراسات سريرية مستقبلية واسعة النطاق إمكانية استخدام تقنية مثيلة الحمض النووي الريبوزي منقوص الأكسجين متعدد الجينات في الدم، القائمة على تفاعل البوليميراز المتسلسل (PCR)، في التنبؤ بتكرار الإصابة بسرطان القولون والمستقيم ومراقبته بدقة وسرعة وفعالية من حيث التكلفة، مما يُمكّن الطب الدقيق من تحقيق فائدة أكبر لمرضى السرطان. وتستند الدراسة إلى اختبار ColonAiQ®، وهو اختبار مثيلة متعدد الجينات لسرطان القولون والمستقيم طورته جامعة نيويورك (KUNY)، وقد أكدت دراسة سريرية مركزية أهميته السريرية في الفحص والتشخيص المبكرين.
أفادت مجلة أمراض الجهاز الهضمي (IF33.88)، وهي المجلة الدولية الأولى في مجال أمراض الجهاز الهضمي في عام 2021، بنتائج الأبحاث متعددة المراكز لمستشفى تشونغشان التابع لجامعة فودان ومستشفى السرطان التابع لجامعة فودان ومؤسسات طبية موثوقة أخرى بالاشتراك مع KUNYAN Biological، والتي أكدت الأداء الممتاز لـ ColonAiQ® ChangAiQ® في الفحص المبكر والتشخيص المبكر لسرطان القولون والمستقيم، واستكشفت في البداية كما تستكشف التطبيق المحتمل في مراقبة تشخيص سرطان القولون والمستقيم.
لمزيد من التحقق من صحة التطبيق السريري لمثيلة ctDNA في تصنيف المخاطر، وتوجيه قرارات العلاج ومراقبة الانتكاس المبكر في سرطان القولون والمستقيم في المرحلة الأولى والثالثة، ضم فريق البحث 299 مريضًا مصابًا بسرطان القولون والمستقيم في المرحلة الأولى والثالثة والذين خضعوا لجراحة جذرية وجمعوا عينات الدم في كل نقطة متابعة (بفارق ثلاثة أشهر) في غضون أسبوع واحد قبل الجراحة، وشهر واحد بعد الجراحة، وفي العلاج المساعد بعد الجراحة لاختبار ctDNA الديناميكي في الدم.
أولاً، وُجد أن اختبار الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) يُمكنه التنبؤ بخطر الانتكاس لدى مرضى سرطان القولون والمستقيم مُبكرًا، سواءً قبل الجراحة أو بعدها. كان لدى المرضى الذين كانت نتيجة اختبار الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) لديهم قبل الجراحة احتمالية أعلى للانتكاس بعد الجراحة مُقارنةً بالمرضى الذين كانت نتيجة اختبارهم سلبية (ctDNA) قبل الجراحة (22.0% > 4.7%). لا يزال اختبار الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) بعد الجراحة مُبكرًا يُتنبأ بخطر الانتكاس: فبعد شهر واحد من الاستئصال الجذري، كان المرضى الذين كانت نتيجة اختبار الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) لديهم احتمالية أكبر للانتكاس بمقدار 17.5 مرة مُقارنةً بالمرضى السلبيين؛ كما وجد الفريق أن الجمع بين اختبار الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) واختبار CEA يُحسّن الأداء بشكل طفيف في الكشف عن الانتكاس (AUC=0.849)، ولكن الفرق لم يكن ذا دلالة إحصائية مُقارنةً باختبار الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) (AUC=0.839) وحده. لم يكن الفرق ذا دلالة إحصائية مُقارنةً باختبار الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) وحده (AUC=0.839).
إن التدريج السريري مع عوامل الخطر هو الأساس الرئيسي حاليًا لتصنيف مرضى السرطان حسب المخاطر، وفي النموذج الحالي، لا يزال عدد كبير من المرضى يتكررون [4]، وهناك حاجة ماسة إلى أدوات تصنيف أفضل حيث يتعايش الإفراط في العلاج ونقص العلاج في العيادة. وبناءً على ذلك، صنف الفريق المرضى المصابين بسرطان القولون والمستقيم في المرحلة الثالثة إلى مجموعات فرعية مختلفة بناءً على تقييم مخاطر الانتكاس السريري (عالي الخطورة (T4 / N2) ومنخفض الخطورة (T1-3N1)) وفترة العلاج المساعد (3/6 أشهر). وجد التحليل أن المرضى في المجموعة الفرعية عالية الخطورة من المرضى الإيجابيين لـ ctDNA كان لديهم معدل تكرار أقل إذا تلقوا ستة أشهر من العلاج المساعد؛ في المجموعة الفرعية منخفضة الخطورة من المرضى الإيجابيين لـ ctDNA، لم يكن هناك فرق كبير بين دورة العلاج المساعد ونتائج المرضى؛ في حين كان لدى المرضى السلبيين لـ ctDNA تشخيص أفضل بشكل ملحوظ من المرضى الإيجابيين لـ ctDNA وفترة أطول خالية من الانتكاس بعد الجراحة (RFS)؛ سرطان القولون والمستقيم في المرحلة الأولى والمرحلة الثانية منخفضة الخطورة لم يعاني جميع المرضى السلبيين لـ ctDNA من الانتكاس في غضون عامين؛ لذلك، من المتوقع أن يؤدي دمج ctDNA مع السمات السريرية إلى تحسين تصنيف المخاطر بشكل أكبر والتنبؤ بالانتكاس بشكل أفضل.
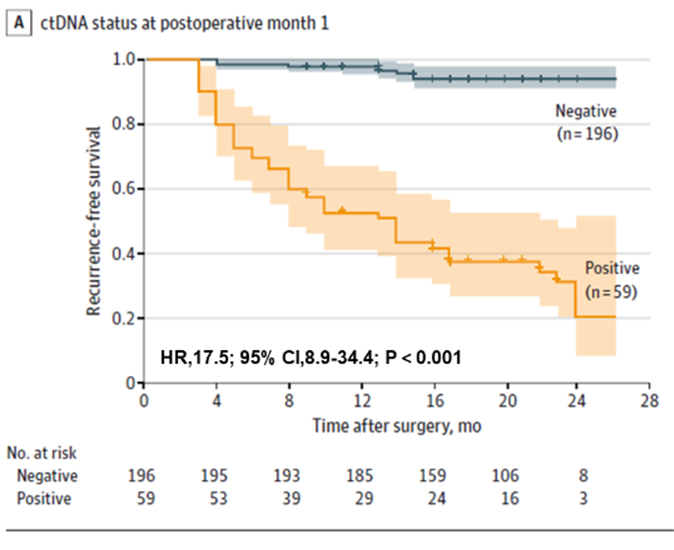
الشكل 1. تحليل الحمض النووي الريبوزي منقوص الأكسجين في البلازما في POM1 للكشف المبكر عن تكرار الإصابة بسرطان القولون والمستقيم
أظهرت نتائج أخرى لاختبار ctDNA الديناميكي أن خطر تكرار المرض كان أعلى بشكل ملحوظ في المرضى الذين كانت نتيجة اختبار ctDNA الديناميكي إيجابية مقارنة بالمرضى الذين كانت نتيجة اختبار ctDNA سلبية أثناء مرحلة مراقبة تكرار المرض بعد العلاج النهائي (بعد الجراحة الجذرية + العلاج المساعد) (الشكل 3ACD)، وأن ctDNA يمكن أن يشير إلى تكرار الورم قبل 20 شهرًا من التصوير (الشكل 3B)، مما يوفر إمكانية الكشف المبكر عن تكرار المرض والتدخل في الوقت المناسب.
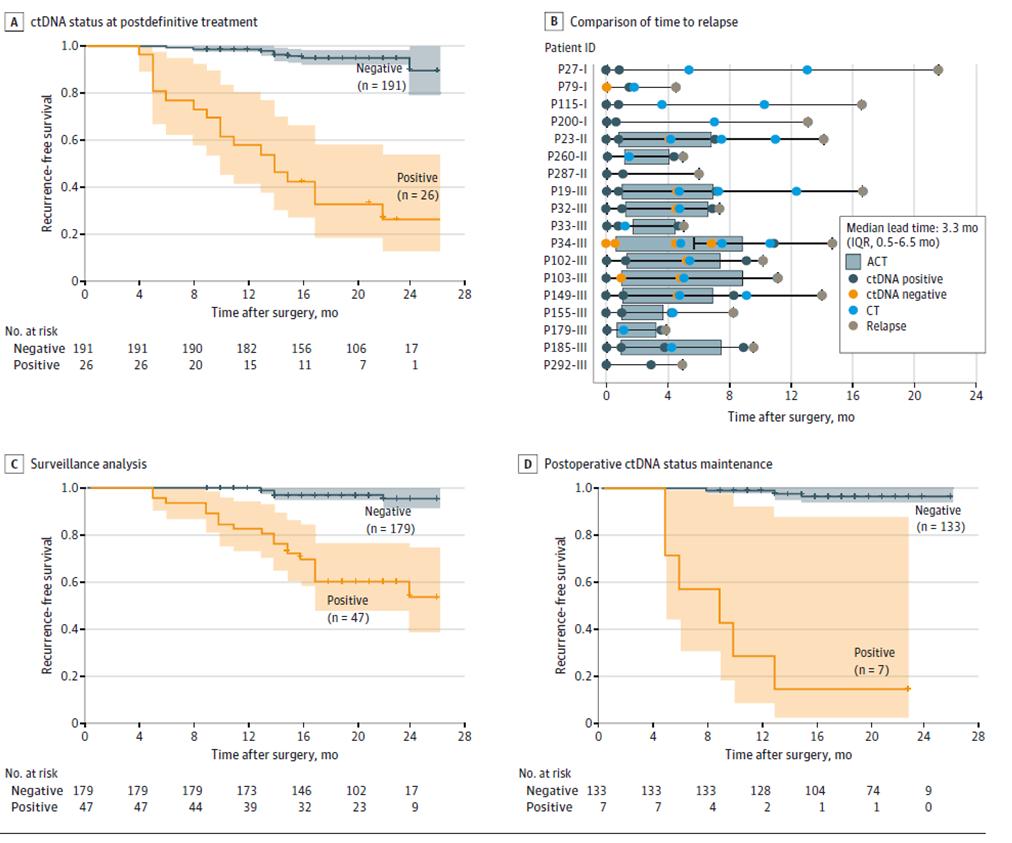
الشكل 2. تحليل الحمض النووي الريبوزي منقوص الأكسجين (ctDNA) استنادًا إلى مجموعة طولية للكشف عن تكرار الإصابة بسرطان القولون والمستقيم
"إن عددًا كبيرًا من دراسات الطب الانتقالي في سرطان القولون والمستقيم تقود هذا التخصص، وخاصة اختبار الحد الأدنى من المخاطر المستند إلى ctDNA والذي يظهر إمكانات كبيرة لتحسين الإدارة بعد الجراحة لمرضى سرطان القولون والمستقيم من خلال تمكين تصنيف مخاطر التكرار وتوجيه قرارات العلاج ومراقبة التكرار المبكر.
تكمن ميزة اختيار ميثلة الحمض النووي كعلامة جديدة لـ MRD بدلاً من اكتشاف الطفرات في أنها لا تتطلب فحص تسلسل الجينوم الكامل لأنسجة الورم، وتستخدم مباشرة في فحص الدم، وتتجنب النتائج الإيجابية الكاذبة بسبب اكتشاف الطفرات الجسدية الناتجة عن الأنسجة الطبيعية والأمراض الحميدة وتكوين الدم المستنسخ.
وتؤكد هذه الدراسة ودراسات أخرى ذات صلة أن اختبار الحد الأدنى للتكرار (MRD) القائم على ctDNA هو عامل الخطر المستقل الأكثر أهمية لتكرار الإصابة بسرطان القولون والمستقيم في المرحلة الأولى والثالثة ويمكن استخدامه للمساعدة في توجيه قرارات العلاج، بما في ذلك "تصعيد" و"تخفيض" العلاج المساعد.
يتطور مجال اختبار تحديد الجينوم المحدود (MRD) بسرعة مع وجود عدد من الاختبارات المبتكرة عالية الحساسية والدقة، القائمة على علم الوراثة فوق الجينية (مثل ميثلة الحمض النووي وتجزئة الجينات) وعلم الجينوم (التسلسل المستهدف فائق العمق أو تسلسل الجينوم الكامل). نتوقع أن يواصل ColonAiQ® تنظيم الدراسات السريرية واسعة النطاق، وأن يصبح مؤشرًا جديدًا لاختبار تحديد الجينوم المحدود (MRD) يجمع بين سهولة الوصول والأداء العالي والتكلفة المعقولة، ويمكن استخدامه على نطاق واسع في الممارسة السريرية الروتينية.
مراجع
[1] مو س، يي ل، وانغ د، هان ل، تشو س، وانغ هـ، داي و، وانغ يي، لو و، وانغ ر، شو ي، كاي س، ليو ر، وانغ زد، كاي ج. الكشف المبكر عن الأمراض الجزيئية المتبقية وتصنيف المخاطر لسرطان القولون والمستقيم من المرحلة الأولى إلى الثالثة عبر ميثلة الحمض النووي للورم الدائر. مجلة الجمعية الطبية الأمريكية للأورام. 20 أبريل 2023.
[2] "عبء مرض سرطان القولون والمستقيم في السكان الصينيين: هل تغير في السنوات الأخيرة؟"، المجلة الصينية لعلم الأوبئة، المجلد 41، العدد 10، أكتوبر 2020.
[3] Tarazona N، Gimeno-Valiente F، Gambardella V، وآخرون. تسلسل الجيل التالي المستهدف للحمض النووي للورم الدائر لتتبع الحد الأدنى من المرض المتبقي في سرطان القولون الموضعي. Ann Oncol. 1 نوفمبر 2019؛ 30(11): 1804-1812.
[4] تايب ج، أندريه ت، أوكلين إي. تحسين العلاج المساعد لسرطان القولون غير النقيلي: معايير ووجهات نظر جديدة. مراجعة علاج السرطان، 2019؛ 75: 1-11.
وقت النشر: ٢٨ أبريل ٢٠٢٣
 中文网站
中文网站